华盛顿(美联社)——印度一家生产二十多种眼药水的制造商受到美国安全警告,已正式召回CVS健康、塔吉特、来德爱和其他全国零售商销售的产品。
Kilitch Healthcare India周一发布了召回通知,美国食品和药物管理局周三发布了通知。这次召回只是走过场,因为美国食品药品监督管理局上个月已经提醒美国商店停止销售这种非处方滴剂。
FDA表示,消费者不应该使用这些产品,因为它们有视力丧失或失明的风险。
FDA官员没有法律权力强迫制造商召回他们的产品,而是依靠公司“自愿”这样做。FDA此前曾表示,它建议制造商在10月25日召回这些眼药水。
总部位于孟买的Kilitch Healthcare表示,尚未收到与该公司产品有关的“任何不良事件报告”。这些润滑滴剂由纽约州法明代尔市的Velocity Pharma公司在美国销售,有效期为2023年11月至2025年9月。
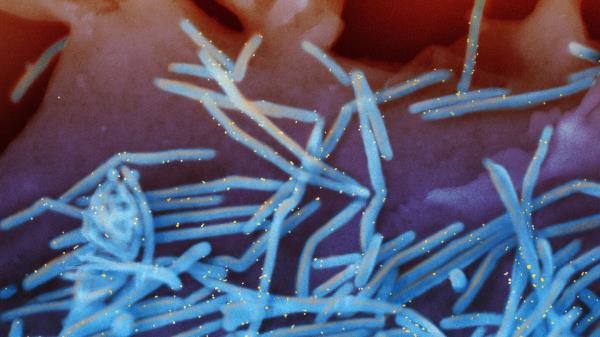
美国食品和药物管理局在最初的警告中说,该机构的检查人员在生产这些滴剂的工厂发现了不卫生的条件和细菌污染。
机构记录显示之前没有对基利奇医疗机构进行检查。FDA只有在检查完成和处理后才会在其在线数据库中发布检查结果。这表明,机构官员可能仍在敲定引发最新召回的检查文件。
美国食品和药物管理局负责确保运往美国的外国产品的安全,尽管它长期以来一直难以跟上越来越多地从印度开始的国际药品供应链的步伐。
最近,该机构一直在努力弥补在COVID-19期间没有进行的遗漏检查。机构记录显示,在疫情最严重的2021财年,FDA没有在印度进行任何检查。在2023财年,检查次数上升到177次,但这仍然是FDA在COVID-19前一年进行的检查次数的一半左右。
CVS Health在一份声明中表示,该公司此前已“停止在实体店和网上销售”FDA提到的所有眼药水。顾客可以将它们退回CVS以获得全额退款。
塔吉特没有回复有关这些产品的电子邮件问题。以“领袖”品牌销售这些产品的医疗用品公司卡地纳健康(Cardinal Health)也没有回复电子邮件。
今年早些时候,联邦官员将一场无关的耐药细菌爆发与两家不同公司——EzriCare和Delsam Pharma的眼药水联系起来。
根据美国疾病控制与预防中心(Centers for Disease Control and Prevention)的最新消息,美国有80多人的眼部感染检测呈阳性。疾控中心称,其中14人视力丧失,4人不得不摘除一只眼睛,4人死亡。
今年2月,这些产品被召回后,卫生检查员走访了印度南部泰米尔纳德邦生产这些眼药水的工厂,发现了这些眼药水的生产和检测方式存在问题,包括消毒措施不足。
___
美联社卫生与科学部得到霍华德休斯医学研究所科学与教育媒体集团的支持。美联社对所有内容全权负责。